試験結果(エビデンス)
ナノゾーンソリューションの効果を示す試験結果(エビデンス)を公開。新型コロナウイルス(COVID-19)、ノロウィルス、インフルエンザウィルスが99.99999%減少し、抗ウィルス活性が認められています。その他、アンモニアガスの除去、O-157や大腸菌などへの殺菌力についても検証済み。マウスに対する急性毒性試験も行い、人体に影響がないことが証明されました。
未来環境促進協会調べ

環境中の新型コロナウイルスの不活化効果試験
検査機関 特定非営利営利活動法人 バイオメディカルサイエンス研究会
試験目的
環境中の新型コロナウイルスの可視光応答光触媒による不活化評価
試験品
nanozone SOLUTION
試験方法
規格 JIS R 1702
環境中(現在、東京のホテルやオフィスビルで採取したばかり)の新型コロナウイルスの可視光応答光触媒による不活化試験
試験結果
新型コロナウイルスの試験結果は『99.99999%』と記載しても問題は無いが『99.99999%』という表記ではなくて『検出限界以下になった。』とする
※『検出限界以下』=100%効果あったという意味です。
この環境下における新型コロナウイルスの不活化試験においては世界初
※また、”世界初”というのは試験方法ではなくて、光触媒で行い、100%の効果が見られたのが”世界初”となります。
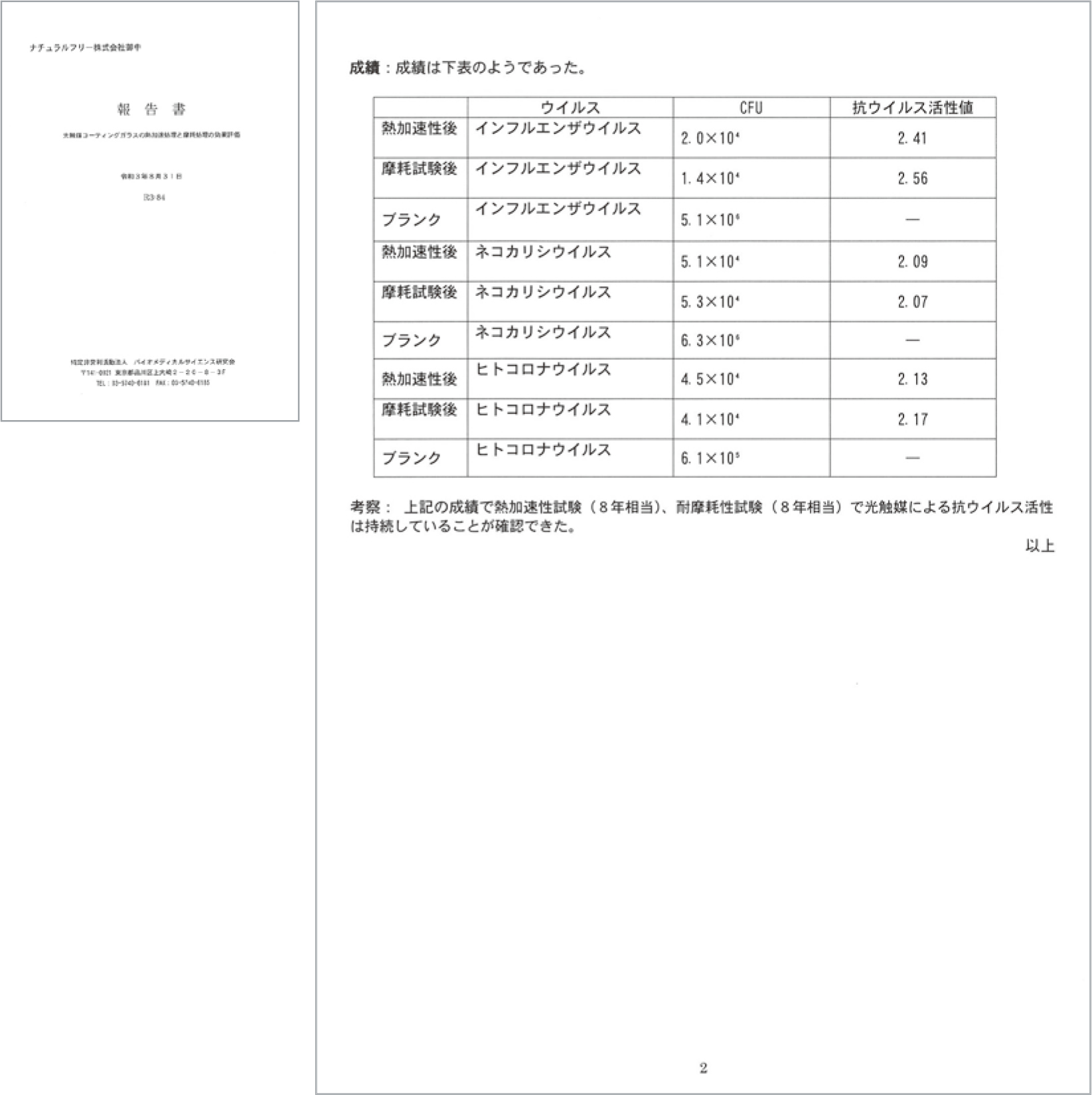
8年の持続性試験(耐摩耗・熱加速)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試驗目的
光触媒コーティングガラスの熱加速処理と摩耗処理の効果評価
試験品
nanozone SOLUTION
試験方法
・熱加速性試験(アレニウスの式に基づく試験)
光触媒塗布ガラス板を 60°Cの恒温槽で 2ヶ月加速性試験に供試し、その後抗ウイルス性試験を行った。
・耐摩耗性試験(JIS A 1454 準拠)
- 光触媒塗布ガラス板を800回転の摩耗試験(8年間相当)後、抗ウイルス試験を行った。
- インフルエンザ、ネコカリシ、ヒトコロナウイルスはそれぞれ0.1ml をサンプルに載せ、ガラス密着法にて可視光1000ルクス、1mW/㎠条件下、それぞれ8時間照射する。
- 8時間後、光触媒コーティングサンプル並びにブランクサンプルよりPBS(培地)で抽出し、残存ウイルス数をプラーク法により測定する。
- 30℃で48 時間培養後、プラーク数をカウントする。
試驗結果
熱加速性試験(8年相当)と耐摩耗試験(8年相当)で光触媒による抗ウイルス活性は持 続していることが確認でき、この2つの試験を行ったことで8年間持続していると証明された。
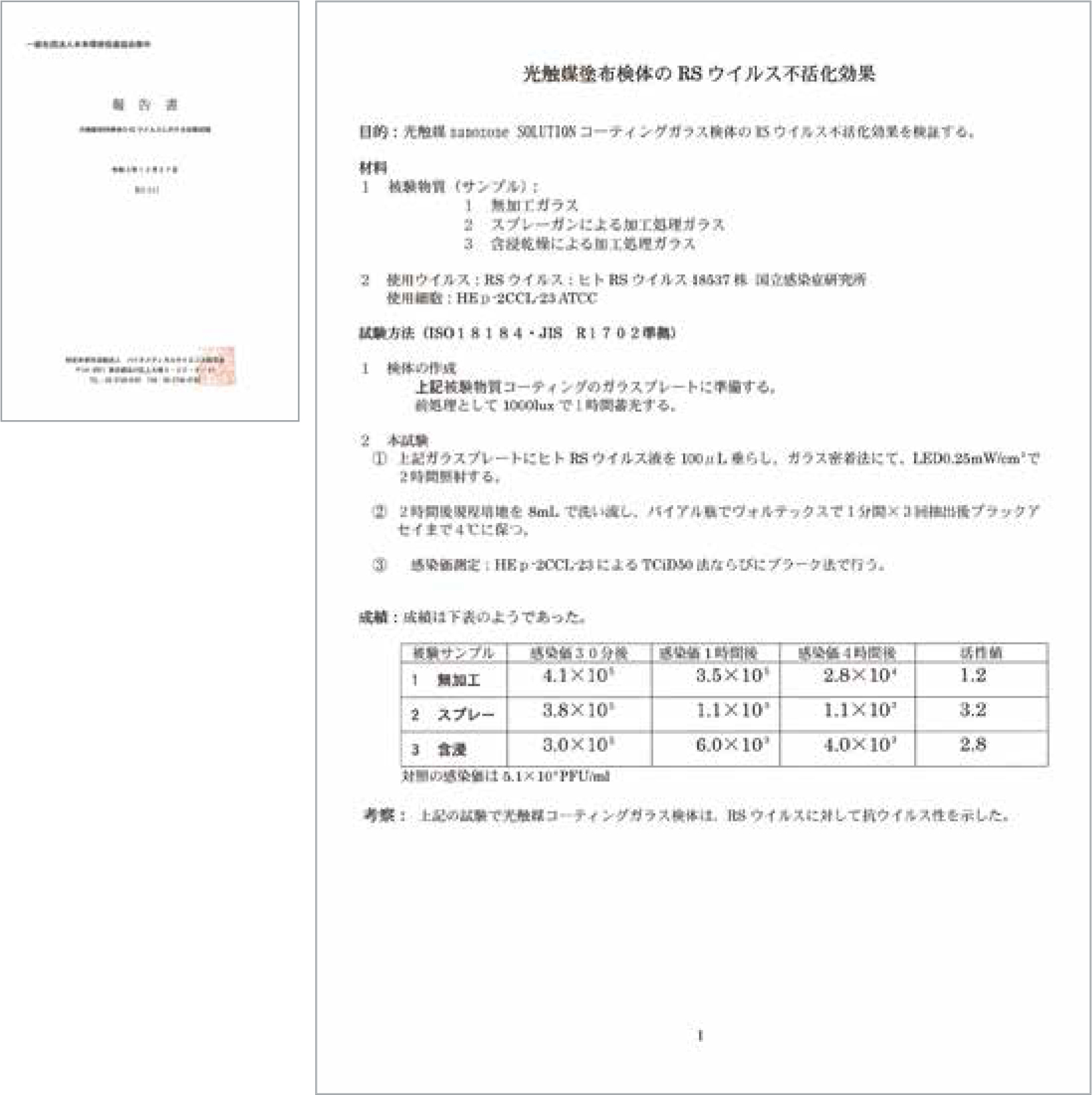
光触媒担持検のRSウイルスに対する効果試験
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試驗目的
光触媒担持検のRSウイルスに対する効果試験
試験品
nanozone SOLUTION
試験方法
IOS 18184準拠
JIS R 1702準拠
- 前処理として、試験品ガラスプレートを1000lxで1時間蓄光する。
- ①にヒトRSウイルス液を100ul垂らし、ガラス密着法にて、25mW/㎠で2時間照明する。
- 2時間後規定培地を9mlで洗い流し、バイアル瓶でかき混ぜて1分間×3回抽出後、プラックアセイを行うまで4°Cに保つ。
- 感染価をHEp -2CCL-23によるTCiD50法ならびにプラーク法で評価する。
試驗結果
RSウイルスは510万個が30分後に38万個まで減少。1時間後に1100個、4時間後には 110個にまで減少した。そのため nanozone SOLUTIONの光触媒によりRSウイルスが 30分後に92.549%、1時間後に99.978%、4時間後には99.998%減少した。
また、抗ウイルス活性値数は3.2であり、この試験によって、nanozone SOLUTIONの光 触媒によるRSウイルスの抗ウイルス性が確認された。
※例) 試験開始時は5.2×10の6乗
“6乗”が“7乗”になれば増加、“5乗”になれば減少と判断する。
“5.2″の数値の変化だけであれば誤差範囲内である。
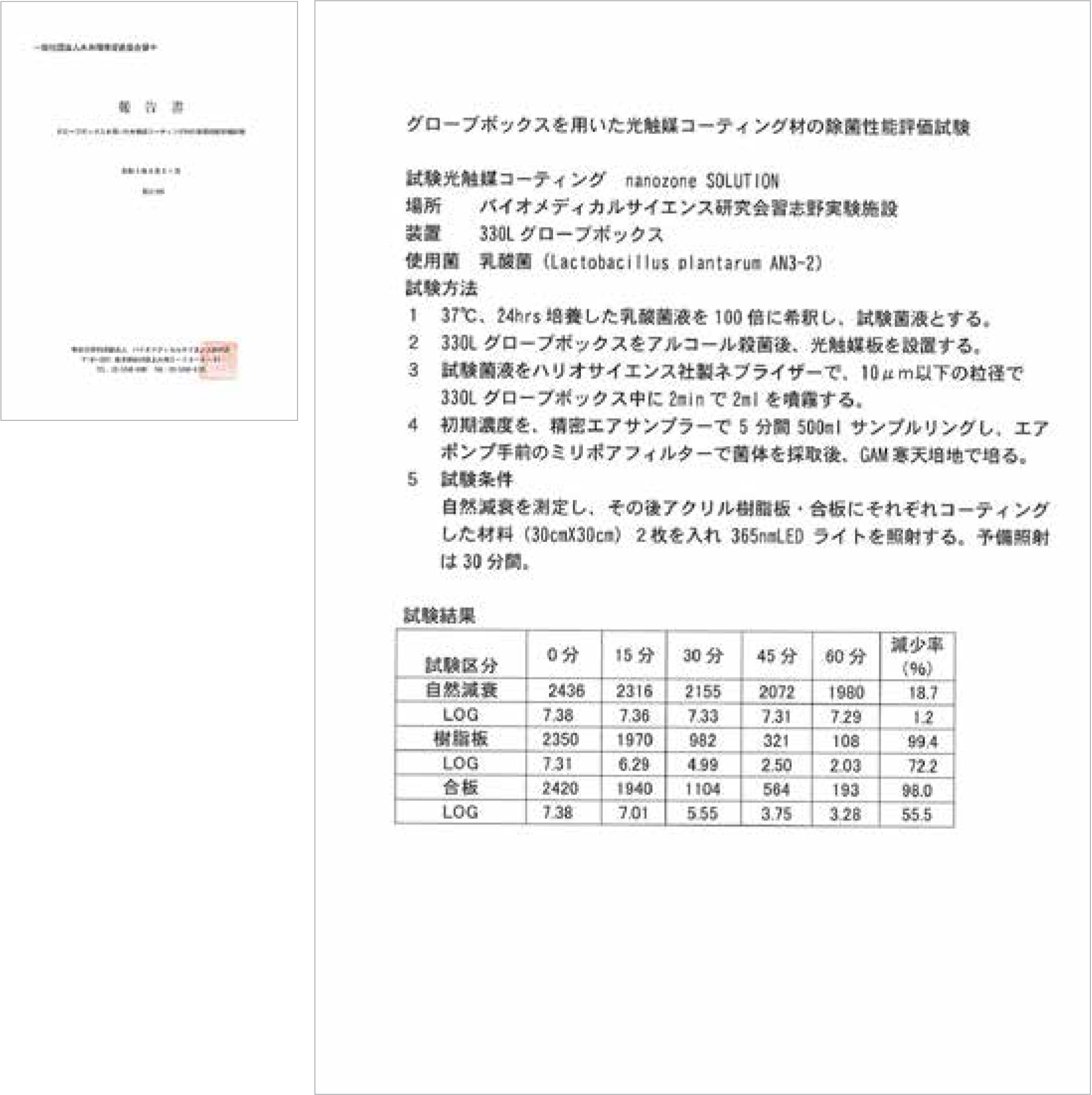
光触媒コーティング材の除菌性能評価試験-01 (実大空間試験)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試驗目的
グローブボックスを用いて光触媒コーティング材の除菌性能を評価する。
試験品
nanozone SOLUTION
試験方法
- 37℃、24hrs培養した乳酸菌液を100倍に希釈し、試験菌液とする。
- 330Lグローブボックスをアルコール殺菌後、光触媒板を設置する。
- 試験菌液をハリオサイエンス社製ネブライザーで、10μm以下の粒径で330Lグロトーブボックス中に2minで2mlを噴霧する。
- 初期濃度を、精密エアサンプラーで5分間500mlサンプルリングし、エアポンプ手前のミリポアフィルターで菌体を採取後、GAM寒天培地で培る。
- 試験条件
自然減衰を測定し、その後アクリル樹脂板・合板にそれぞれコーティングした材料(30cm×30cm)2枚を入れ、365nmLEDライトを照射する。予備照射は30分間。
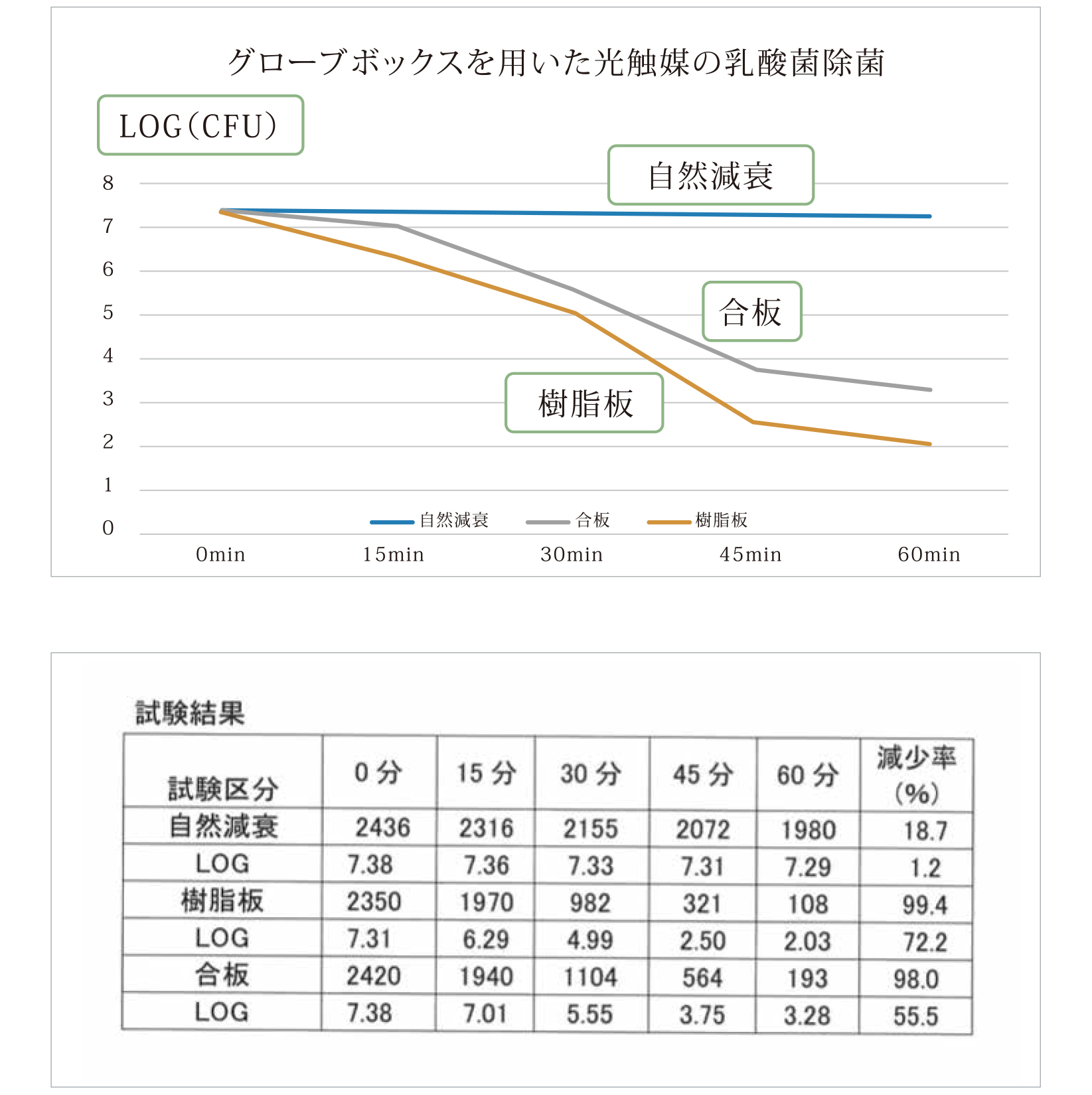
光触媒コーティング材の除菌性能評価試験-02 (実大空間試験)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試驗結果
今回の実験データで、乳酸菌に対する除去率β=1-exp[-kit]β=0.48 (実測値)であった。1時間でLOGで2桁以上低下しており、十分な除菌効果が認められた。
k:乳酸菌殺菌係数ウイルスはその3倍
①β(ベータ)=1…の計算式は、除去率の計算方法で、ISO規格の計算式に基づいて
います
②LOGとは?
活性値数のことです。
報告書での2桁というのは、数学の際の2桁という考えとは異なっており、例えば“7”と いう数字が“5”になるということを2桁減少と表記しております。
1LOG=10分の1
2LOG=100分の1
3LOG=1000分の1
上記のことにより、1時間で99.4%減少するということになります。
③ウイルスは乳酸菌の3倍の殺菌効果があります。
例えば、乳酸菌が0.03であれば、ウイルスは0.01で、6LOG (1,000,000分の1)になるため、同じ試験内容でウイルスで行った場合、検出されない(乳酸菌より殺菌効果が高い)という結果になるということを表しています。

光触媒コーティング材による アレルゲン分解性能評価試験(スギ花粉)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試験目的
光触媒コーティング材によるアレルゲン分解性能(スギ花粉のアレルゲン)を 評価する。
試験品
nanozone SOLUTION
試験方法
- アレルギー検査キットの反応部分を取り出し、光触媒コーティングガラスに載せ、LEDランプ1000ルクスにて30分間照射する。対照(ブランク)は照射しない。その後、取り出したアレルギー検査キットの反応部分は検査キットに戻す。
- 陽性検体(アレルギーの方の血液)を処方のとおり、アレルギー検査キットに入れる。
- 展開液(生理食塩水)を5滴加え、20分間置き、バンドの生成を確認する。
- 試験条件:①の前に光触媒コーティングガラスを予備照射で30分間、25℃にて反応させた(蓄光)。
試驗結果
光触媒によるアレルゲンの分解活性をアレルギー検査キットを用いて試験した結果、 1000ルクス30分で分解した。
上記より、nanozone SOLUTIONはスギ花粉の分解を証明できた。

光触媒コーティング材による アレルゲン分解性能評価試験(ネコアレルゲン)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試験目的
光触媒コーティング材によるアレルゲン分解性能(ネコのアレルゲン)を評価する。
試験品
nanozone SOLUTION
試験方法
- アレルギー検査キットの反応部分を取り出し、光触媒コーティングガラスに載せ、LEDランプ1000ルクスにて30分間照射する。対照(ブランク)は照射しない。その後、取り出したアレルギー検査キットの反応部分は検査キットに戻す。
- 陽性検体(アレルギーの方の血液)を処方のとおり、アレルギー検査キットに入れる。
- 展開液(生理食塩水)を5滴加え、20分間置き、バンドの生成を確認する。
- 試験条件:①の前に光触媒コーティングガラスを予備照射で 30分間25℃にて反応させた(蓄光)。
試驗結果
光触媒によるアレルゲンの分解活性をアレルギー検査キットを用いて試験した結果、1000ルクス30分で分解した。
上記より、nanozone SOLUTIONはネコのアレルゲンの分解を証明できた。

光触媒コーティング材による アレルゲン分解性能評価試験(ヒョウダニ)
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試験目的
光触媒コーティング材によるアレルゲン分解性能(ヒョウダニのアレルゲン)を評価する。
試験品
nanozone SOLUTION
試験方法
- アレルギー検査キットの反応部分を取り出し、光触媒コーティングガラスに載せ、LEDランプ1000ルクスにて30分間照射する。対照(ブランク)は照射しない。その後、取り出したアレルギー検査キットの反応部分は検査キットに戻す。
- 陽性検体(アレルギーの方の血液)を処方のとおり、アレルギー検査キットに入れる。
- 展開液(生理食塩水)を5滴加え、20分間置き、バンドの生成を確認する。
- 試験条件:①の前に光触媒コーティングガラスを予備照射で30分間25℃にて反応させた(蓄光)。
試驗結果
光触媒によるアレルゲンの分解活性をアレルギー検査キットを用いて試験した結果、1000ルクス30分で分解した。
上記より、nanozone SOLUTIONはヒョウダニのアレルゲンの分解を証明できた。

抗菌性(黄色ぶどう球菌)
試験方法
供試菌
試験結果
| 試料※1 | 生菌数の常用対数値 | (理論上の菌数【=10^log(V)】) | 理論上の菌減少率 | |||||
| 接種直後 | 8時間光照射後※2 | 8時間暗所保存後 | 接種直後 | 8時間光照射後※2 | 8時間暗所保存後 | |||
| 「ナノソルコンフォート」処理 | 原品 | – | <1.3 | <1.3 | – | 20 | 20 | 99.98% |
| ブランク(未施工) | 4.3 | 4.8 | 5.3 | 25,119 | 50,119 | 100,000 | ||
※1 紫外線放射照度1mW/㎤、24時間のブラックライトによる事前照射を実施した。
※2 紫外線放射照度0.1mW/㎠のブラック台と照射下で試験を実施した。

アンモニアガスの除去性能評価試験
検査機関 一般財団法人カケンテストセンター
試験方法
SEKマーク繊維製品認証基準で定める方法((一社)繊維評価技術議会)
ただし、試料量は200㎠とした。
<使用バッグの種類>スマートバッグPA(ジーエルサイエンス社製)
試験結果
| 試料 | 初発濃度(ppm) | 2時間後 | |
| ガス濃度(ppm) | 減少率(%) | ||
| 原布 | 100 | ≦0.5 | ≧99 |
| ブランク(空試験) | 100 | 81 | – |
2時間後のガス減少率99%

ノロウィルスに対する効果評価
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試験目的
使用ウィルス
試験品
nanozone SOLUTION
試験方法
ISO18184準拠
- nanozone SOLUTION0.99mlを蓋付ガラス瓶内に入れておく。ここに0.01mlのウィルス液を加え25℃にて蓋付ガラス瓶内にて1分と5分反応させる。
- 1分後、5分後に細胞培地9mlを加え、かき混ぜて1分間×3回混合する。
試験結果
nanozone SOLUTIONにより、ネコカリシウィルスが99.99999%減少。
ネコカリシウィルスは610万個が1分後に7万個まで減少。5分後には検出限界以下になり、抗ウィルス活性が認められた。
※例)試験開始時は5.2×10の6乗。7乗になれば増加、5乗になれば減少と判断する。5.2の数値の変化だけであれば誤差範囲内である。

マウスに対する急性毒性試験(経口・24時間)
試験方法
① 投与液を調製
試験品に精製水を加えて20%懸濁液としたものを投与用資料とした。
② 使用動物および投与方法
マウス(ddY系、雄、5匹)を投与前4時間絶食させ、経口ゾンデ針を用いて胃内に1回強制投与した。投与量が体重1kg当たり試験品4g相当量。
③ 観察方法と期間
投与後の異常の有無について、24時間観察した。
試験品
nanozone SOLUTION
試験結果
マウスに異常を認めない
マウス実験により人が誤飲してもリスクが少ない事が証明された。

マウスに対する急性毒性試験(経口・1週間)
試験方法
① 投与液を調製
試験品に精製水を加えて20%懸濁液としたものを投与用資料とした。
② 使用動物および投与方法
マウス(ddY系、雄、5匹)を投与前4時間絶食させ、経口ゾンデ針を用いて胃内に1回強制投与した。投与量が体重1kg当たり試験品4g相当量。
③ 観察方法と期間
投与後の異常の有無について、1週間観察した。
試験品
nanozone SOLUTION
試験結果
マウスに異常を認めない
マウス実験により人が誤飲してもリスクが少ない事が証明された。

マウスに対する急性毒性試験(経口・2週間)
試験方法
① 投与液を調製
試験品に精製水を加えて20%懸濁液としたものを投与用資料とした。
② 使用動物および投与方法
マウス(ddY系、雄、5匹)を投与前4時間絶食させ、経口ゾンデ針を用いて胃内に1回強制投与した。投与量が体重1kg当たり試験品4g相当量。
③ 観察方法と期間
投与後の異常の有無について、2週間観察した。
試験品
nanozone SOLUTION
試験結果
マウスに異常を認めない
マウス実験により人が誤飲してもリスクが少ない事が証明された。

抗菌効果試験
試験方法
nanozone SOLUTION 1mlに対し、大腸菌24万個・黄色ブドウ球菌38万個を投与し24時間経過後の菌数を測定
試験品
nanozone SOLUTION
試験結果
| 供試菌 | 大腸菌 | 黄色ブドウ球菌 |
| 初発菌数 | 240,000/ml | 380,000/ml |
| 24時間経過後の菌数 | ||
| 試験品 | 0/ml | 0/ml |
| 空試験 | 12,000,000/ml | 370,000/ml |



微生物検査
試験方法
通常のオフィス下で使用した100cm×100cmのプラスチック製のプレート上の菌を採取。
nanozone SOLUTIONの噴霧後、室内光があたる環境下において1時間後と1週間後の菌数を測定。
試験結果
nanozone SOLUTION噴霧前の菌数は100個以上を示していたが、nanozone SOLUTION噴霧後の1時間後には菌数が10個未満になった。
上記検査方法で1週間継続したところ、同じく菌数は10個未満であった。
菌の増殖は確認できませんでした。
※10個未満の個数は表示されないため0個の可能性もある

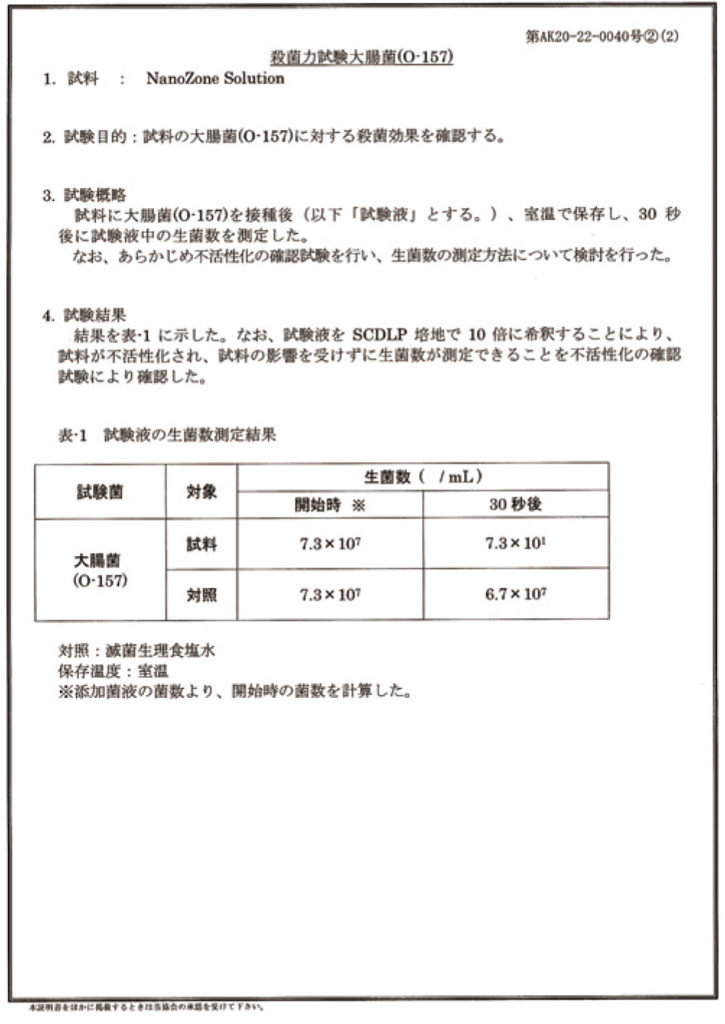

殺菌力試験
試料
nanozone SOLUTION
試験目的
試験方法
nanozone SOLUTIONに大腸菌(O-157)を摂取後(以下『試験液』とする)、室温で保存し30秒後に試験液中の生菌数を測定した。
試験結果
大腸菌(O-157)7300万個が30秒後に73個まで減少。
nanozone SOLUTIONにより99.99999%減少したと言える。



殺菌力試験
試料
試験目的
試験方法
試験結果

ヒトコロナウィルスに対する効果評価
試験目的
使用ウィルス
ヒトコロナウィルス(Human Coronavirus 229E(ATCC VR-740))
試験品
nanozone SOLUTION
試験方法
ISO18184準拠
- nanozone SOLUTION0.99mlを蓋付ガラス瓶内に入れておく。ここに0.01mlのウィルス液を加え25℃にて蓋付ガラス瓶内にて1分と5分反応させる。
- 1分後、5分後に細胞培地9mlを加え、かき混ぜて1分間×3回混合する。
試験結果
nanozone SOLUTIONにより、ヒトコロナウィルスが99.99999%減少。
ヒトコロナウィルスは520万個が1分後に2800個まで減少。5分後には検出限界以下になり、抗ウィルス活性が認められた。
※ヒトコロナウィルスは新型コロナウィルスと骨格や遺伝子配列が98%同じものである。
※例)試験開始時は5.2×10の6乗。7乗になれば増加、5乗になれば減少と判断する。5.2の数値の変化だけであれば誤差範囲内である。

ノロウィルスに対する効果評価
検査機関 特定非営利活動法人 バイオメディカルサイエンス研究会
試験目的
使用ウィルス
試験品
nanozone SOLUTION
試験方法
ISO18184準拠
- nanozone SOLUTION0.99mlを蓋付ガラス瓶内に入れておく。ここに0.01mlのウィルス液を加え25℃にて蓋付ガラス瓶内にて1分と5分反応させる。
- 1分後、5分後に細胞培地9mlを加え、かき混ぜて1分間×3回混合する。
試験結果
nanozone SOLUTIONにより、ネコカリシウィルスが99.99999%減少。
ネコカリシウィルスは610万個が1分後に7万個まで減少。5分後には検出限界以下になり、抗ウィルス活性が認められた。
※例)試験開始時は5.2×10の6乗。7乗になれば増加、5乗になれば減少と判断する。5.2の数値の変化だけであれば誤差範囲内である。

インフルエンザウィルスに対する効果評価
試験目的
使用ウィルス
試験品
nanozone SOLUTION
試験方法
ISO18184準拠
- nanozone SOLUTION0.99mlを蓋付ガラス瓶内に入れておく。ここに0.01mlのウィルス液を加え25℃にて蓋付ガラス瓶内にて1分と5分反応させる。
- 1分後、5分後に細胞培地9mlを加え、かき混ぜて1分間×3回混合する。
試験結果
nanozone SOLUTIONにより、インフルエンザウィルスA型が99.99999%減少。
インフルエンザウィルスA型は230万個が1分後に150個まで減少。5分後には検出限界以下になり、抗ウィルス活性が認められた。
※例)試験開始時は5.2×10の6乗。7乗になれば増加、5乗になれば減少と判断する。5.2の数値の変化だけであれば誤差範囲内である。

光触媒によるヒトコロナウイルスに対する効果評価
試験目的
光触媒によるヒトコロナウイルスに対する効果評価を行う
試験品
nanozone SOLUTION
試験方法
ISO18184準拠
- 5㎝×5㎝ガラス板に、光触媒被験物質nanozone SOLUTIONを均一に噴霧し、24時間安全キャビネット内で風乾する。
- ①に200μlウイルス液を載せ、LED照明200lux下、25℃にて、8時間反応させる。対象被験物質の代わりにPBSを用いる。
- 2時間後ならびに8時間後に細胞培地を9ml加え、かき混ぜて1分間×3回混合する。
- 感染価をプラーク法で評価する。
試験結果
ヒトコロナウイルスは520万個が2時間後には31万個まで減少。8時間後には1800個までに減少した。そのためnanozone SOLUTIONの光触媒によりヒトコロナウイルスが2時間後には94.038%、8時間後には99.965%減少した。
また、抗ウイルス活性値数は3.0以上であり、この試験によって、
nanozone SOLUTIONの光触媒によるヒトコロナウイルスの抗ウイルス性が確認された。
※ヒトコロナウイルスは新型コロナウイルスと骨格や遺伝子配列が98%同じものである。
※例)試験開始時は5.2×10の6乗
7乗になれば増加、5乗になれば減少と判断する。
5.2の数値の変化だけであれば誤差範囲内である。

nanozone SOLUTIONのラットにおける急性経口毒性試験
検査機関 株式会社 薬物安全性試験センター
試験目的
本被験物質をラットに単回経口投与して毒性を明らかに、安全性を評価する。
試験品
nanozone SOLUTION
試験方法
SIAA品質と安全性に関する自主規格を参考に実施
nanozone SOLUTIONの急性経口毒性試験についてラット雌性を用いて検討を実施。
SIAA品質と安全性に関する自主規格を参考にして、第1回投与群として2000mg/kg用量を3匹に投与し死亡例が認められないことを確認後、第2回投与群として同様量を3匹に投与した。
試験動物は各群を含め計6匹とした。
試験結果
2000mg/kg用量で死亡は認められなかった。
各群とも死亡例は認められず、死亡率は0%であった。

nanozone SOLUTIONの細菌を用いる復帰突然変異試験
検査機関 株式会社 薬物安全性試験センター
試験目的
nanozone SOLUTIONの安全性評価の一環として、細菌を用いて遺伝子突然変異誘発能の有無を明らかにする。
試験品
nanozone SOLUTION
試験方法
労働安全衛生法第57条の4第1項の規定に基づき厚生労働大臣の定める基準
(厚生労働省告示第208号)
nanozone SOLUTIONの遺伝子突然変異誘発能の有無を検討するため、ネズミチフス菌および大腸菌を用いて代謝活性化しない場合の条件下で、プレインキュベーション法により実施した。
試験結果
容量設定試験および本試験ともに代謝活性化の有無にかかわらず、塩基対置換型およびフレームシフト型のいずれの菌株においても陰性対象値の2倍以上となる復帰変異コロニー数の増加は認められず用量反応性も認められなかった。以上の試験結果により、本試験条件下においてはnanozone SOLUTIONは、細菌に対する遺伝子突然変異誘発能を有さない【陰性】と判定した。

nanozone SOLUTIONのウサギにおける急性皮膚刺激性試験
検査機関 株式会社 薬物安全性試験センター
試験目的
本被験物質の皮膚刺激性についてウサギを用いて検討し、安全性を評価した。
試験品
nanozone SOLUTION
試験方法
SIAA品質と安全性に関する自主規格を参考に実施
試験動物として日本白色種ウサギの雌3匹を用い、除毛した背部皮膚を投与部位とした。被験物質の原液(100%)を投与試料とし、2.5×2.5cm大のリント布に投与試料を0.5ml含浸させて投与部位に貼付し、粘着性伸縮包帯を用いて4時間の半閉塞貼付を行った。貼付除去1、24、48および72時間後に皮膚反応の判定を行った。なお、初回試験については貼付除去直後も判定した。
試験結果
その結果、初回試験ならびに確認試験ともに、いずれの判定時においても皮膚反応は見られず、P.I.I.は0であった。観察期間中の一般状態に異常は見られず、体重も増加を示した。以上の結果により、本試験条件下において、本被験物質に皮膚刺激性は認められず、本被験物質の皮膚刺激評価区分は無刺激物と結論された。

nanozone SOLUTIONのモルモットにおける皮膚感作性試験
検査機関 株式会社 薬物安全性試験センター
試験目的
本被験物質の皮膚感作性についてモルモットを用いて検討し、安全性を評価した。
試験品
nanozone SOLUTION
試験方法
SIAA品質と安全性に関する自主規格を参考に実施
nanozone SOLUTIONの皮膚感作性についてモルモットを用いてMiximization Test法で検討した。
試験動物として、予備試験4匹、感作群10匹、対照群5匹の計19匹を試験に供した。感作群の皮内感作は被験物質の5w/w%液、接触感作は被験物質の原液(100%)とし、対照群は各感作時の媒体を用いた。惹起は被験物質の原液(100%)、30および10w/w%液とした。
試験結果
感作群および対照群ともに、いずれの惹起投与試料においても皮膚反応はみられず、感作率は0%であった。試験期間中の一般状態に異常はみられず、体重も増加を示した。以上の結果より、本試験条件下において、本被験物質の皮膚感作性は認められなかった。
エビデンス取得状況1
| 検査内容 | 取得機関名 | 取得日 |
| 抗菌性(不織布1点) | 一般社団法人カケンテストセンター 大阪事業所 生物ラボ | 2019年8月20日 取得済 |
| ガスの除去性能評価試験(ナノソルコンフォート) | 一般社団法人カケンテストセンター 大阪事業所 分析ラボ | 2019年10月9日 取得済 |
| マウスに対する急性毒性試験(経口・24時間) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月5日 取得済 |
| マウスに対する急性毒性試験(経口・1週間後) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月12日 取得済 |
| マウスに対する急性毒性試験(経口・2週間後) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月18日 取得済 |
| 抗菌効果試験(大腸菌・黄色ブドウ球菌) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月23日 取得済 |
| 持続性(噴霧後1時間) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月18日 取得済 |
| 持続性(噴霧後1週間) | 一般社団法人東京都食品衛生協会 東京食品技術研究所 | 2020年6月25日 取得済 |
| O-157 | 日本油料検定協会 兵庫県神戸市 | 2020年7月13日 取得済 |
| ブドウ球菌 | 日本油料検定協会 兵庫県神戸市 | 2020年7月13日 取得済 |
| インフルエンザA | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年7月29日 取得済 |
| ネコカリシウィルス(ノロウィルス) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年7月29日 取得済 |
| ヒトコロナウィルス(ATCC 229E) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年7月29日 取得済 |
| 持続性試験(3年間) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2023年7月末 取得予定 |
| インフルエンザA | 一般社団法人カケンテストセンター 大阪事業所 | 2020年8月末 取得予定 |
| ネコカリシウィルス(ノロウィルス) | 一般社団法人カケンテストセンター 大阪事業所 | 2020年8月末 取得予定 |
| インフルエンザA | 北里大学北里研究所メディカルセンター | 取得予定 |
| ネコカリシウィルス(ノロウィルス) | 北里大学北里研究所メディカルセンター | 取得予定 |
| スギ花粉アレルゲン | 東京環境アレルギー研究所 | 取得予定 |
| 光触媒によるヒトコロナウイルス(ATCC 229E) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年8月17日 取得済 |
| ラットにおける急性経口毒性試験(SIAA基準) | 株式会社 薬物安全性試験センター | 2020年8月5日 取得済 |
| 細菌を用いる復帰突然変異試験(SIAA基準) | 株式会社 薬物安全性試験センター | 2020年9月1日 取得済 |
| ウサギにおける急性皮膚刺激性試験(SIAA基準) | 株式会社 薬物安全性試験センター | 2020年10月26日 取得済 |
| モルモットにおける皮膚感作性試験(SIAA基準) | 株式会社 薬物安全性試験センター | 2020年10月26日 取得済 |
| 新型コロナウイルス | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年10月26日 取得済 |
| 8年の持続性試験(耐摩擦・熱加熱) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年8月31日 取得済済 |
エビデンス取得状況2
| 検査内容 | 取得機関名 | 取得日 |
| アレルゲン分解性能評価試験(スギ花粉) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年8月31日 取得済 |
| アレルゲン分解性能評価試験(猫アレルゲン) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年8月31日 取得済 |
| アレルゲン分解性能評価試験(ヒョウダニ) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年8月31日 取得済 |
| 実大空間試験 | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年8月31日 取得済 |
| RSウイルスに対する効果試験 | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2021年12月27日 取得済 |
| 消臭(アンモニア) | 一般社団法人ボーケン品質評価機構 大阪事業所 | 取得予定 |
| 消臭(タバコ) | 一般社団法人ボーケン品質評価機構 大阪事業所 | 取得予定 |
| 光の種類(ブラックライト) | 一般社団法人カケンテストセンター 大阪事業所 | 取得予定 |
| 光の種類(蛍光灯) | 一般社団法人カケンテストセンター 大阪事業所 | 取得予定 |
| 光の種類(LED) | 機関未定 | 取得予定 |
| 急性毒性経口(SIAA基準) | 株式会社 薬物安全性試験センター | 8月中旬 取得予定 |
| 皮膚一次刺激性(SIAA基準) | 株式会社 薬物安全性試験センター | 8月中旬 取得予定 |
| 変異原生(SIAA基準) | 株式会社 薬物安全性試験センター | 8月中旬 取得予定 |
| 皮膚感作性(SIAA基準) | 株式会社 薬物安全性試験センター | 10月中旬 取得予定 |
| 抗菌性(SIAA基準) | 一般社団法人ボーケン品質評価機構 大阪事業所 | 2020年11月末 取得予定 |
| SIAA | 一般社団法人 抗菌製品技術協議会 | 2020年12月末 取得予定 |
| 抗菌試験(PIAJ基準) | 機関未定 | 取得予定 |
| 抗ウィルス試験(PIAJ基準) | 機関未定 | 取得予定 |
| PIAJ | 光触媒工業会 | 取得予定 |
| SARS | 機関未定 | 取得予定 |
| コケ | 機関未定 | 取得予定 |
| 防汚 | 機関未定 | 取得予定 |
| 呼吸器系 | 機関未定 | 取得予定 |
| 光触媒の窒素酸化物除去性能試験 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 持続性試験(4ヶ月分) | 特定非営利活動法人 バイオメディカルサイエンス研究会 | 2020年12月末 取得予定 |
| 消耗 | 機関未定 | 取得予定 |
エビデンス取得状況3
| 検査内容 | 取得機関名 | 取得日 |
| 光触媒の窒素酸化物除去性能試験 -再生率- | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のアセトアルデヒド除去性能試験 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒の窒素酸化物除去性能試験 -バッグ法- | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のトルエン除去性能試験 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のホルムアルデヒド除去性能試験 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のセルフクリーニング試験 湿式分解性能の測定 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のセルフクリーニング試験 水接触角の測定 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒の水浄化性能試験(JISR1704準拠)(明条件のみ) | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒の水浄化性能試験(JISR1704準拠)(暗条件のみ) | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| その他光触媒性能試験 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒性能試験JIS試験条件不成立時(試験途中中止時) | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 水接触角の測定(光触媒JIS試験以外) | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 水接触角の測定(光触媒JIS試験以外)追加 | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒試料調製(処理時間30分につき) | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
| 光触媒のアセトアルデヒド除去性能試験-バッグ法- | 地方独立行政法人 神奈川県立産業技術総合研究所(KISTEC) | 取得予定 |
世界基準の抗菌対策
nanozone COAT
永続的抗菌コーティング
空間を強力除菌!

世界基準の抗菌対策
nanozone COAT
永続的抗菌コーティング
空間を強力除菌!






